Versión 2 - 02/06/20
Recado actualizado ante la publicación de nuevos estudios en pacientes con infección por SARS-CoV-2: un experimento clínico aleatorizado (ECA) (evaluando resultados sobre la carga viral) y dos de tipo observacional (con registro de desenlaces clínicos).
Dado que no se ha identificado beneficio con el uso de antimaláricos en pacientes hospitalizados por la COVID-19 y los resultados disponibles sugieren exceso de mortalidad o arritmias ventriculares severas en pacientes tratados, en tanto se conozcan resultados sobre desenlaces clínicos de pacientes en estudios experimentales, se recomienda no prescribir estos medicamentos para esta indicación, a excepción de la participación en estos estudios.
Calidad de la evidencia: baja (riesgo moderado de sesgos, inconsistencia de resultados, sesgos de publicación en reportes iniciales).
Otros mensajes clave
- A la fecha no están disponibles resultados de estudios experimentales que hayan evaluado la incidencia de eventos clínicos y la seguridad en pacientes infectados con SARS-CoV-2 (COVID-19) tratados o no con antimaláricos.
- El aclaramiento de la carga viral ha sido similar en pacientes que recibieron o no hidroxicloroquina (HCQ) en un ECA con suficiente poder para este desenlace (1). Estos resultados, que difieren de estudios in vitro y observacionales publicados previamente, no han sido replicados hasta el momento.
- El riesgo reportado de arritmias ventriculares severas en pacientes con la COVID-19 tratados con antimaláricos aumenta cuando se combina con macrólidos.
- El perfil de eventos adversos de la cloroquina incluye anemia, trombocitopenia o leucopenia, prolongación del intervalo QT o bradicardia y alteración de la función renal y hepática, especialmente en el tratamiento prolongado.
Es importante saber lo que no se conoce
No se tiene certidumbre sobre la relación entre el aclaramiento viral inducido por un tratamiento y su efecto sobre desenlaces clínicos.
No se tiene certeza sobre el impacto clínico del tratamiento con antimaláricos. De hecho, un análisis interino en un ECA de gran tamaño, que recomendó continuar la asignación aleatoria a este tratamiento, mostró un efecto estadísticamente diferente al exceso de riesgo identificado por un estudio observacional de gran tamaño.
Antecedentes
Después de la identificación inicial del virus SARS-CoV-2 en China y la descripción posterior de la COVID-19 como entidad clínica (2), los antimaláricos fueron uno de los primeros tratamientos recomendados para su control (3). La cloroquina, uno de estos medicamentos, se ha utilizado en todo el mundo por más de 70 años. Es parte de la Lista Modelo de la Organización Mundial de la Salud (OMS) de medicamentos esenciales, tiene bajo costo y un perfil de seguridad clínica ya establecido (4). Durante la epidemia por SARS en 2005, fue estudiada como alternativa de tratamiento (5).
En el contexto de la actual pandemia, emergieron reportes de actividad antiviral in vitro (6) y luego series de casos de pacientes con la COVID-19 que reportaban efectos positivos de tratamiento con hidroxicloroquina (HCQ). Estos efectos eran potencialmente sinérgicos en la combinación con el antibiótico macrólido azitromicina (7). Con base en estos resultados iniciales, y ante la rápida expansión y crecimiento de la epidemia, estos medicamentos llegaron a ser recomendados ampliamente por diversas asociaciones y autoridades, al punto de ver reducida su disponibilidad (8).
En la primera versión de este recado, la recomendación emitida era débil a favor para el uso de antimaláricos, con consideraciones adicionales (usar en el contexto hospitalario, en casos de mayor severidad, bajo monitoreo) y de carácter temporal, en tanto se disponía de evidencia directa y de mejor calidad. A propósito de los reportes recientes de estudios en pacientes con la COVID-19, se presenta una segunda versión.
A junio 1 de 2020, se encontraban registrados en clinicaltrials.gov 136 estudios que evalúan el tratamiento con antimaláricos en pacientes con la COVID-19 (97 con HCQ (9) y 39 con cloroquina (10)). Pero ya se dispone de los primeros resultados de estudios, principalmente observacionales y empiezan a aparecer los de algunos ECA de pequeño tamaño. Ante la reacción suscitada por estos primeros resultados, un ECA de gran tamaño con HCQ actualmente en curso (el estudio Recovery, con más de 10.000 pacientes aleatorizados al final de Mayo de 2020), decidió continuar la asignación aleatoria en este brazo(11). La decisión de continuidad se basó en un análisis interino que mostró una diferencia estadísticamente significativa frente a un exceso de riesgo reportado por un estudio observacional de gran tamaño. También, el 3 de junio el director general de la OMS anunció que el comité de monitoreo de datos recomendó continuar la asignación aleatoria a HCQ en el estudio Solidarity que sobrepasa los 3500 pacientes aleatorizados a sus diferentes brazos (12). En tanto, al momento de escribir este informe, se han expresado dudas sobre la integridad de los datos de este estudio y ha recibido algunos cuestionamientos (11)
Este resumen evalúa la evidencia disponible sobre la efectividad y seguridad de los antimaláricos en el tratamiento de la COVID-19, a la que en próximas versiones posiblemente se sumarán los resultados de otros ECA ya registrados. La información sobre el uso de otros medicamentos con los que se han combinado los antimaláricos, principalmente macrólidos, se presenta en otro Recado.
Estudios incluidos en este Recado
Esta actualización se basa en 3 estudios que incluyeron pacientes con diagnóstico de infección por SARS-Cov-2 por RT PCR. Se trata de un experimento aleatorizado de etiqueta abierta (1), una cohorte retrospectiva (13) y el análisis de un registro prospectivo de casos (14). Los estudios se identificaron por monitoreo de los repositorios de evidencia de las principales revistas médicas internacionales.
Criterios de selección: Estudios en pacientes con infección por SARS-Cov-2 tratados con Hidroxicloroquina o Cloroquina asociada o no a otros medicamentos, que registraran mortalidad o desenlaces de progresión clínica de la COVID-19, o ensayos clínicos aleatorizados (ECA) que registraran desenlaces de carga viral.
Hallazgos
El estudio de Tang et al. (2020) (1), asignó pacientes mayores de 18 años admitidos a hospitales de China a recibir manejo estándar con la adición o no de HCQ (dosis de carga de 1200 mg/día por 3 días, seguido de 800 mg/día por 2-3 semanas, dependiendo de la severidad de la enfermedad). El desenlace primario fue la conversión a un estatus negativo de RT-PCR a los 28 días de la aleatorización. El análisis de seguridad incluyó diversos eventos de interés, divididos en serios o no serios. Este ECA, que por diseño incluiría 360 pacientes, fue detenido luego de un primer análisis interino con 150 participantes, excluyendo por falta de información el desenlace clínico planeado originalmente.
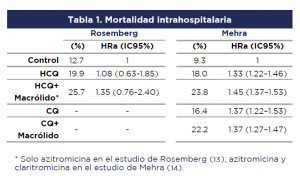
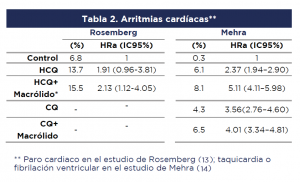
El estudio de Rosemberg et al. (2020) (13) fue una cohorte retrospectiva de pacientes con la COVID-19, admitidos en diversos hospitales del estado de Nueva York. Se tomaron registros clínicos electrónicos por muestra aleatoria estratificada. Después de revisar la elegibilidad, se incluyeron registros de 1438 casos, de los cuales 735 habían recibido HCQ y Azitromicina; 271 HCQ solamente, mientras que 221 no recibieron ninguno de estos medicamentos (los pacientes que recibieron Azitromicina solamente no hacen parte del análisis de este Recado). Los desenlaces analizados fueron mortalidad intrahospitalaria por cualquier causa o un compuesto de paro cardíaco, arritmias o prolongación del intervalo QT documentadas por electrocardiograma. No se registraron otros desenlaces de seguridad.
El estudio de Mehra et al. (2020) (14), es un registro internacional prospectivo de gran tamaño, que incluyó 96032 pacientes con diagnóstico virológico confirmado en diversos hospitales del mundo. Este reporte presenta un análisis por la exposición a tratamientos con cloroquina (solamente [n=1868] o acompañada de un macrólido [n=3783]), HCQ (solamente [n=3016] o acompañada de un macrólido [n=6221]) o no haber recibido ninguno de estos tratamientos (n=81144). Los desenlaces de interés fueron mortalidad intrahospitalaria por cualquier causa o la ocurrencia de arritmias cardíacas clínicamente importantes (taquicardia ventricular no sostenida o sostenida, o fibrilación ventricular) durante la hospitalización. No se registraron otros desenlaces de seguridad.
Los principales hallazgos fueron:
- En el ECA analizado, la mediana de tiempo a la conversión virológica (8 versus 7 días) y la probabilidad de alivio de los síntomas a los 28 días (67% versus 60%) no difirieron estadísticamente entre los grupos manejados con HCQ o cuidado estándar.
- En este mismo estudio, la probabilidad de conversión virológica a los 28 días fue similar en el grupo que recibió HCQ (85.4%, IC95% 73.8 – 93.8) comparado con el asignado a manejo estándar (81.3%, IC95% 71.2 – 89.6).
- Ambos estudios observacionales identificaron un exceso en la tasa de mortalidad intrahospitalaria y en la incidencia de arritmias registradas en los grupos que fueron tratados con antimaláricos. Este exceso fue aún mayor al combinarlo con macrólidos (tablas 1 y 2):
- En el registro internacional de hospitales, la dosis media diaria de cloroquina fue 765 (DE 308) mg por 6.6 (DE 2.4) días. La dosis de HCQ fue 596 (DE 126) mg por 4.2 (DE 1.9) días.
Referencias
Tang W, Cao Z, Han M, Wang Z, Chen J, Sun W et al. Hydroxychloroquine in patients with mainly mild to moderate coronavirus disease 2019: open label, randomised controlled trial. BMJ. 2020;369:m1849. http://doi.org/ggwprd.
Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020.
Guidelines for the Prevention, Diagnosis, and Treatment of Novel Coronavirus-induced Pneumonia, The 6th ed. (Abstract en inglés) http:// www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326d d94d329df351d7da8aefc2/files/b218cfeb1bc54639af227f9 22bf6b817.pdf (accessed February 23, 2020). (in Chinese).
Colson P, Rolain J-M, Raoult D. Chloroquine for the 2019 novel coronavirus SARS-CoV-2. Int J Antimicrob Agents. 2020:105923
Vincent MJ, Bergeron E, Benjannet S, Erickson BR, Rollin PE, Ksiazek TG, Seidah NG, Nichol ST. Chloroquine is a potent inhibitor of SARS coronavirus infection and spread. Virol J. 2005. Aug 22;2:69. PubMed PMID: 16115318; PubMed Central PMCID: PMC1232869.
Yao X, Ye F, Zhang M, Cui C, Huang B, Niu P, Liu X et al. In vitro antiviral activity and projection of optimized dosing design of hydroxychloroquine for the treatment of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Infect Dis. 2020 Mar 9. pii: ciaa237. doi: 10.1093/cid/ciaa237. [Epub ahead of print] PubMed PMID: 32150618.
Gautret P, Lagiera JC, Parola P, Hoanga VT, Meddeba L, MailheaM et al. Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. International Journal of Antimicrobial Agents – (In Press) 17 March 2020 – doi:10.1016/j.ijantimicag.2020.105949 http://doi.org/dp7d
Reuters Edición América Latina [Internet]. New York: Agencia de Noticias Reuters; 2020 [acceso 02 junio de 2020]. FDA anuncia escasez medicamentos contra malaria por alta demanda relacionada a coronavirus. Disponible en https://reut.rs/372Gg7a
ClinicalTrials.gov [Internet]. Maryland: US National Library of Medicine [acceso 02 de junio de 2020]. Find Studies. Disponible en: https://bit.ly/2XSoe3m
ClinicalTrials.gov [Internet]. Maryland: US National Library of Medicine [acceso 02 de junio de 2020]. Find Studies. Disponible en: https://bit.ly/3059CAa
Recovery Trial [Internet]. Oxford: University of Oxford; 2020 [acceso 02 junio de 2020]. Recruitment to the Recovery Trial continues as planned. Disponible en: https://bit.ly/2Xp77qK
World Health Organization [Internet]. Ginebra:World Health Organization [acceso 02 junio de 2020]. WHO Director-General's opening remarks at the media briefing on COVID-19 - 03 June 2020. Disponible en: https://bit.ly/2XrZHmx
Rosenberg E, Dufort EM, Udo T, Wilberschied LA, Kumar J, Tesoriero J et al. Association of treatment with hydroxychloroquine or azithromycin with in-hospital mortality in patients with covid-19 in NewYork State. JAMA. 2020 [publicado online mayo 11]. doi:10.1001/jama.2020.8630
Mehra MR, Desai SS, Ruschitzka F, Patel AN. Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis. 2020 [Publicado online mayo 22]. doi.org/10.1016/S0140-6736(20)31180-6