
Versión 2 - 01/12/2020
Recado actualizado ante la publicación de dos ensayos clínicos aleatorizados con evidencia directa – Ver versión 1 – 10/04/2020
La adición de azitromicina al cuidado usual no resultó en mejoría clínica ni reducción de mortalidad. Por tanto, no se recomendaría el uso de azitromicina como parte del tratamiento de pacientes hospitalizados con COVID-19.
Calidad de la evidencia: baja (proveniente de estudios experimentales con riesgo de sesgo serio y resultados imprecisos).
Otro mensaje clave:
La adición de azitromicina al tratamiento de pacientes con COVID-19, no resultó en diferencia en la tasa de eventos adversos serios que incluían prolongación del intervalo QT corregido (QTc).
Es importante saber lo que no se conoce
No se conoce el efecto de la azitromicina como parte del tratamiento de pacientes con diagnóstico de COVID-19 que no requieren hospitalización.
No se conoce el impacto de la administración de azitromicina en relación con el tiempo desde el inicio de los síntomas.
Antecedentes
La neumonía constituye la manifestación grave más frecuente de la COVID-19 (1) y dado que puede no ser posible descartar una neumonía bacteriana subyacente, la Organización Mundial de la Salud (OMS) y otros grupos científicos propusieron el uso de terapia antibiótica como parte del arsenal terapéutico en este escenario (2,3).
El uso de macrólidos como una alternativa potencial de tratamiento se postuló por su amplia disponibilidad y su uso previo en infecciones respiratorias agudas y crónicas. Además de su efecto antibacteriano, los macrólidos han recibido atención por su efecto inmunomodulador y antinflamatorio, con una posible aplicación en infecciones respiratorias de origen viral (4) y por la actividad in vitro de la azitromicina en Zika y Ébola (5, 6).
Sin embargo, la evidencia sugiere que la azitromicina puede aumentar el riesgo de arritmias ventriculares fatales y de paro cardiaco por prolongación del intervalo QTc (7), riesgo que puede incrementar por el uso de otros fármacos como la hidroxicloroquina, que se conoce prolongan el intervalo QTc (8).
La versión anterior de este recado incluía un análisis retrospectivo de un estudio de cohorte multicéntrico en pacientes con MERS (9) y un estudio clínico no aleatorizado en pacientes con la COVID- 19 (10), que no mostraban beneficio adicional en la eliminación del virus (ARN de MERS-CoV) de las secreciones respiratorias, ni en la reducción de mortalidad (ver versión 1 del Recado).
Esta actualización adiciona información de dos ensayos clínicos aleatorizados (ECA) que evaluaron la eficacia y seguridad de la adición de azitromicina en el tratamiento de la COVID-19.
Información en la que se basa este Recado
La búsqueda para actualización se realizó en la Plataforma L.OVE (Living Overview of Evidence) de la Fundación Epistemonikos. Se consultó el L.OVE de Coronavirus Disease (COVID-19) que compila artículos publicados a la fecha sobre esta enfermedad (11); la pregunta en formato PICO para la búsqueda se construyó a partir de los términos “población COVID-19”, “prevention and treatment”, “pharmacological interventions”, “antimicrobials”, “antibiotics”, “macrolides”, “azithromycin” (12).
Se identificaron nueve ECA que reportaban resultados. Se seleccionaron dos que presentaban datos específicos sobre azitromicina en pacientes con COVID-19: Calvacanti et al. (13) y Furtado et al. (14).
Hallazgos
Se incluyeron dos ECA, de etiqueta abierta, de grupos paralelos, realizados en diferentes centros de Brasil entre finales de marzo y mediados de mayo. La descripción de los estudios se encuentra en la tabla 1:
Tabla 1. Descripción de los estudios Coalition I y Coalition II

Los principales hallazgos de estos estudios fueron:
- En COALITION I y II la edad promedio de los pacientes fue de 50 y 59 años ( % hombres 58 y 66%) respectivamente.
- El tiempo promedio desde el inicio de los síntomas hasta la aleatorización en COALITION I y II fue de 7 y 8 días, respectivamente.
- Ninguno de los dos estudios logró mostrar diferencias clínicas con el uso de azitromicina en el desenlace primario de deterioro clínico.
- En pacientes menores de 60 años o en quienes se administró tratamiento antiviral (principalmente oseltamivir), se presentaron peores resultados en el desenlace primario de deterioro clínico al día 15 cuando se adicionó azitromicina al tratamiento (14).
Tabla 2. Hallazgos de los estudios Coalition I y Coalition II
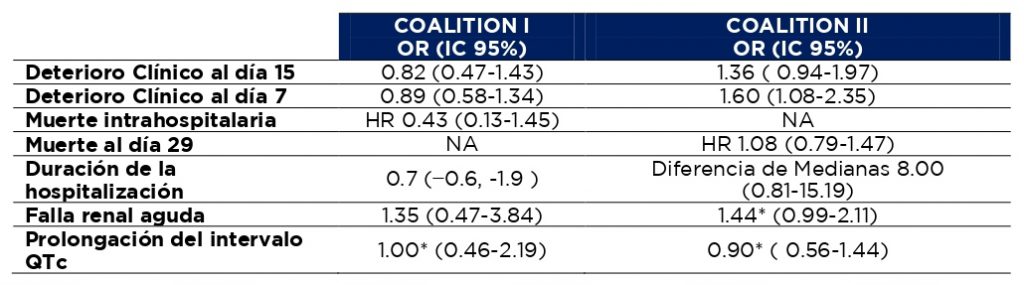
*Calculado
Información sobre la evidencia que soporta este recado
De acuerdo con la herramienta RoB2 (Risk of Bias) (15) para evaluación de riesgo de sesgo en ECA, los estudios de Cavalcanti et al. y Furtado et al. fueron calificados con riesgo de sesgo moderado.
La certeza en la evidencia para los desenlaces deterioro clínico al día 15, mortalidad intrahospitalaria y mortalidad al día 29 es “moderada” debido al riesgo de sesgo serio de los estudios.
Referencias
Guan WJ, Ni ZY, Hu Y, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med 2020.
Jin, Y., Cai, L., Cheng, Z. et al. A rapid advice guideline for the diagnosis and treatment of 2019 novel coronavirus (2019-nCoV) infected pneumonia (standard version). Military Med Res 7, 4 (2020). http://doi.org/dp93
Clinical management of severe acute respiratory infection (SARI) when COVID-19 disease is suspected. Interim Guidance. World Health Organization; March 13, 2020.
Critically important antimicrobials for human medicine – 5th rev. Geneva: World Health Organization; 2017.
Retallack H, Di Lullo E, Arias C, Knopp KA, Laurie MT, Sandoval-Espinosa C, et al. Zika virus cell tropism in the developing human brain and inhibition by azithromycin. Proc Natl Acad Sci U S A. 2016 Dec 13;113(50):14408-14413. Epub 2016 Nov 29.
Madrid PB, Panchal RG, Warren TK, Shurtleff AC, Endsley AN, Green CE, Kolokoltsov A, et al. Evaluation of Ebola Virus Inhibitors for Drug Repurposing. ACS Infect Dis. 2015 Jul 10;1(7):317-26. http://doi.org/dp94. Epub 2015 May 11.
Maisch NM, Kochupurackal JG, Sin J. Azithromycin and the risk of cardiovascular complications. J Pharm Pract. 2014;27(5):496–500.
Mercuro NJ, Yen CF, Shim DJ, et al. Risk of QT interval prolongation associated with use of hydroxychloroquine with or without concomitant azithromycin among hospitalized patients testing positive for coronavirus disease 2019 (COVID-19). JAMA Cardiol 2020. published online May 1. https://doi.org/10.1001/jamacardio.2020.1834.
Arabi YM, Deeb AM, Al-Hameed F, Mandourah Y, Almekhlafi GA, Sindi AA et al Saudi Critical Care Trials group. Macrolides in critically ill patients with Middle East Respiratory Syndrome. Int J Infect Dis. 2019 Apr;81:184-190. http://doi.org/dp95. Epub 2019 Jan 25. PubMed PMID: 30690213.
Gautret et al. (2020) Hydroxychloroquine and azithromycin as a treatment of COVID‐19: results of an open‐label non‐randomized clinical trial. International Journal of Antimicrobial Agents – In Press 17 March 2020 – http://doi.org/dp7d
OVE platform. Coronavirus disease (COVID-19) [Internet]. 2020 [cited 2020 Nov 26]. Available from: https://app.iloveevidence.com/loves/5e6fdb9669c00e4ac072701d
OVE platform. Macrolides for Coronavirus infection [Internet]. 2020 [cited 2020 Oct 19]. Available from: https://app.iloveevidence.com/loves/5e6fdb9669c00e4ac072701d?question_domain=5b1dcd8ae611de7ae84e8f14&population=5e6fdab269c00e4ac072701c&intervention=5d3af53adaeedf163a21b983
Cavalcanti AB, Zampieri FG, Rosa RG, Azevedo LCP, Veiga VC, Avezum A, et al. Hydroxychloroquine with or without Azithromycin in Mild-to-Moderate Covid-19. N Engl J Med. 2020;1–12.
Furtado RHM, Berwanger O, Fonseca HA, Corrêa TD, Ferraz LR, Lapa MG, et al. Azithromycin in addition to standard of care versus standard of care alone in the treatment of patients admitted to the hospital with severe COVID-19 in Brazil (COALITION II): a randomised clinical trial. Lancet. 2020;396(10256):959–67.
Sterne J, Savović J, Page M, Elbers R, Blencowe N, Boutron I, et al. RoB 2: a revised tool for assessing risk of bias in randomised trials. BMJ. 2009;(366):l4898.
